2016年春,一位25歲的小夥子走進了上海市肺科醫院肺循環科的門診,原來他前幾天準備去切除扁桃體,但是住院期間卻發現有明顯的低氧血症,因此耳鼻喉科醫生說:先别做手術了,先找呼吸科醫生看看吧。
小夥子兩歲時體檢發現尿隐血陽性,19歲時經腎活檢确診為IgA腎病。爸爸媽媽以此為由,讓他平時多休息,少活動。小夥子畢業後從事程序員工作,但平時很少和同事們一起去玩,稍微活動多一些就感覺累。但是他平時沒有注意到這個,隻覺得自己身體素質不好。
進入肺循環科病房後,醫生給他做了體格檢查,發現小夥子口唇紫绀,有杵狀指(趾),雙肺呼吸音清,沒有聽到羅音;心髒的聽診也是正常的。

上圖 患者的杵狀指
實驗室檢查:
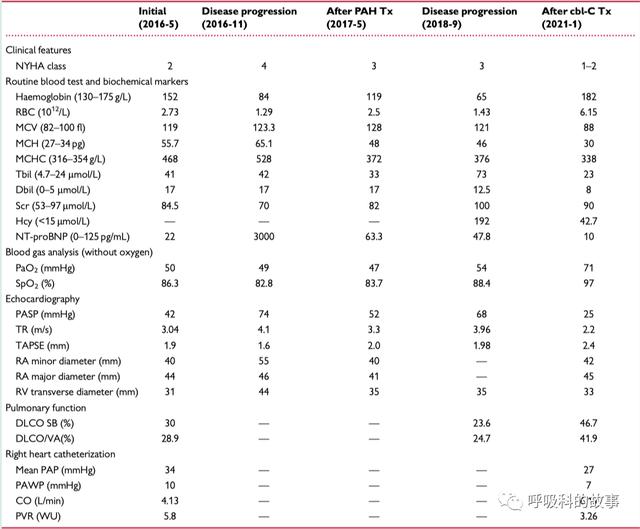
血常規:紅細胞2.73*10^12/L,血紅蛋白152g/L;
動脈血氣顯示PaO2水平為50mmhg,氧飽和度86.3%;
生化:總膽紅素41umol/L(參考範圍4.7-24),間接膽紅素17umol/L(參考範圍0-5);
N端腦鈉肽前體22pg/ml(參考範圍0-125)
自身抗體和血管炎抗體:陰性;
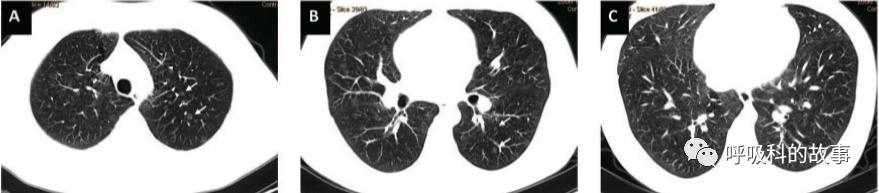
CT顯示兩肺彌漫性小葉中心磨玻璃影和結節影(圖1A-C):
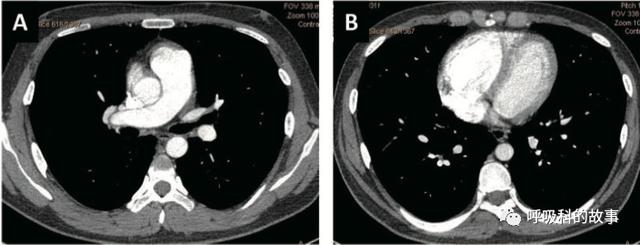
肺動脈擴張和右心室增大:
肺功能測試顯示彌散功能嚴重下降(DLCO僅30%),通氣功能正常。
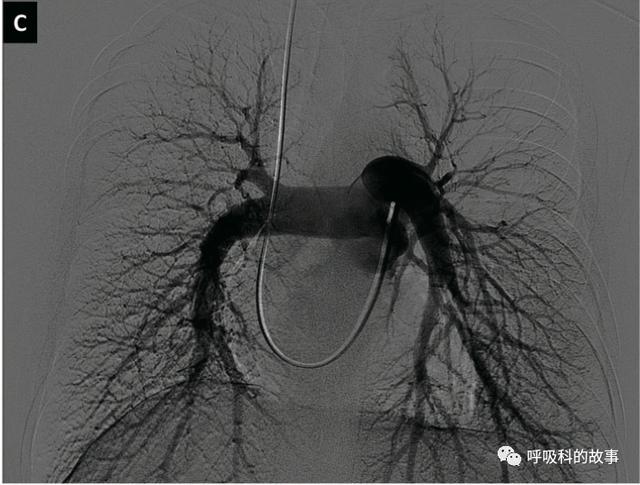
由于超聲心動圖提示“疑似PH可能”,予以行右心導管(RHC)和肺動脈造影(圖2C),顯示肺動脈平均壓為34 mm Hg,肺小動脈楔壓為10 mm Hg,肺血管阻力為5.8 WU。
因此,肺靜脈閉塞病/肺毛細血管瘤病(PVOD/PCH)被高度懷疑,予以氧療。為了确認診斷,進行了EIF2AK4突變的基因檢測,結果為陰性。
小夥子回家後,體力越來越差,吸氧的時間也越來越長,最後也放棄工作在家。可憐他的父母親隻有這麼一個兒子,不離不棄四處求醫。
第一次出院的五個月後(2016年11月),患者突然出現惡心和嘔吐,氣急加重,于是再次來到肺科醫院肺循環科求助。這一次的化驗檢查有了新的變化:
N末端腦利鈉肽(NT-proBNP,3000 pg/ml)顯著升高;
動脈血氣分析:氧分壓49mmhg,氧飽和度82.8%;
超聲心動圖估測肺動脈收縮壓(PASP)升高(74 mmHg);
全血計數顯示大細胞貧血,血紅蛋白顯示為84 g/L;
生化:總膽紅素和直接膽紅素分别升高至42 µmol/L和17 µmol/L;
Coombs試驗陽性;
維生素B12和葉酸水平正常;
骨髓穿刺顯示巨幼細胞改變。
因此,診斷更正為:溶血性貧血相關肺動脈高壓。予以強的松,安立生坦(5mg QD)和西地那非(20mg TID)治療。經過6個月治療,患者氣促症狀減輕,NT-proBNP和PASP下降。然而,他的低氧血症仍沒有改善。
就這樣,可憐的小夥子在家裡靠着藥物和氧氣又生活了2年,雖然病情曾一度好轉,2017年5月複查血紅蛋白回升到了119g/L,心超顯示的肺動脈收縮壓(PASP)(47 mmHg)。
可是,好景不長,2018年9月他的病情再次惡化,表現在貧血嚴重加重和肺動脈壓力進一步增高,相關的化驗結果如下:
N末端腦利鈉肽(NT-proBNP,47.8pg/ml);
動脈血氣分析:氧分壓54mmhg,氧飽和度88.4%;
超聲心動圖估測肺動脈收縮壓(PASP)升高(68 mmHg);
全血計數顯示大細胞貧血,血紅蛋白顯示為65 g/L;
生化:總膽紅素和直接膽紅素分别升高至73 µmol/L和12.5 µmol/L;
肺循環科的醫生們陷入了沉思?他們将病人的情況羅列了一下:
肺動脈高壓是原發性還是繼發性的?如果是繼發性又是什麼原因引起的呢?
患者為什麼會出現貧血?又是大細胞性貧血?是維生素B12缺乏還是葉酸缺乏呢?可是一個城市男孩平時也沒有挑食,按理不應該會出現貧血呀?
肺動脈收縮壓與貧血嚴重程度似乎有種關系,即貧血程度越重,肺動脈收縮壓越高,這兩者有聯系嗎?
就在大家苦思冥想的時候,有人突然發現了一個問題:該患者血清同型半胱氨酸異常增高192 μmol/L (正常值: <15 μmol/L)。這能不能成為一個突破口呢?于是大家一邊查閱資料,一 邊請教兒科專家。兒科專家的建議是進一步查甲基丙二酸的水平。不查不知道,一查吓一跳,患者血漿甲基丙二酸的水平明顯增高(101.5 μmol/L [正常值:0.2–5.6 μmol/L]),高度懷疑甲基丙二酸血症。再對其尿樣行質譜分析顯示甲基丙二酸-2(50.97μmol/L [NV:0.2–3.6μmol/L])和2-甲基-3-羟基丁酸-1-2(50.97μmol/L[NV:0–0.3μmol/L])異常增高。
肺循環科醫生終于迫近真相了,他們動員患者進行遺傳分析檢測,結果顯示,該患者MMACHC基因的雜合突變位于染色體1(GRCh37)c.80A>G,p.Gln27Arg和c.394C>T,p.Arg 132X上。最終該患者被診斷為成人遲發性钴胺素C(英文縮寫cbl-C)缺陷。
确診後,該患者開始服用維生素B12、甜菜堿、左旋肉堿和葉酸,患者的呼吸困難在6個月内得到緩解。開始治療後一年複查的CTPA掃描顯示彌漫性肺部病變顯著減少。複查超聲心動圖和RHC顯示輕度PH,右心功能恢複正常。2021年1月化驗結果如下:
N末端腦利鈉肽(NT-proBNP,10pg/ml);
動脈血氣分析:氧分壓71mmhg,氧飽和度97%;
超聲心動圖估測肺動脈收縮壓(PASP)(25 mmHg);
血常規:紅細胞6.15*10^12/L,血紅蛋白182g/L;
生化:總膽紅素和直接膽紅素分别降低至42 µmol/L和17 µmol/L;
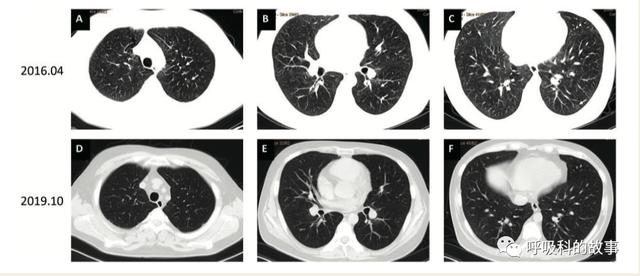
随着治療後情況的好轉,小夥子又逐漸恢複了精氣神,可以出去散步活動了,原來丢掉的工作也再次得到了。他的父母再次收獲健康的兒子,無比開心。而作為醫者,能再造生命奇迹,也是無比榮光的事情。
以下是患者幾次化驗檢查結果的總結:
肺循環科的醫生們查閱文獻,發現這是全球首例報告的成人Cbl-C缺陷引起的肺動脈高壓病例,并且剛剛發表在《歐洲心髒病雜志》(《European Heart Journal- case reports》),作者是趙勤華、王岚、吳文彙(前三位是上海肺科醫院肺循環科,傅立軍(上海兒童醫學中心)。
該文章雖為短篇臨床病例報告,卻體現出國際期刊對罕見病例的重視程度,也體現了上海市肺科醫院肺循環團隊在該領域的診治水平。
讨論:
要了解這個病的來龍去脈,我們要複習一下大學時的生物化學知識了,來講講同型半胱氨酸和甲基丙二酸吧。你是不是聽到“生化”就“方”了?

血漿同型半胱氨酸(英文縮寫Hcy)是蛋氨酸代謝過程中的中間産物,血漿中存在氧化型和還原型HCY兩種形式,氧化型含二硫基,包括同型胱氨酸和 胱氨酸;還原型含硫基,包括同型半胱氨酸及半胱氨酸。正常機體存在少量同型半胱氨酸,還原型僅占 2%。
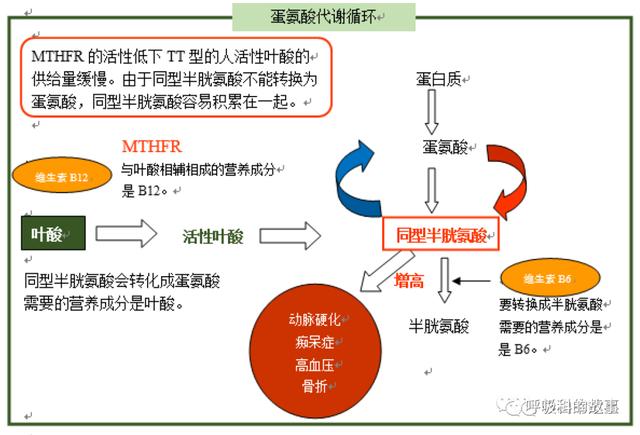
Hcy 在細胞内代謝途徑有三條:(1)Hcy在蛋氨酸合成酶及輔酶維生素B12參與下,與5- 甲基四氫葉酸合成蛋氨酸和四氫葉酸,而5-甲基四氫葉酸是在亞甲基四氫葉酸還原酶(Methylenetetrahydrofolate reductase , MTHFR)催化下還原而來;(2)Hcy在胱硫醚-β-合成酶(Cystathionineβ–Synthase,CBS)及 輔酶維生素B6參與下,與 絲氨酸縮合成胱硫醚,胱硫醚進一步斷裂成胱氨;(3)Hcy在細胞内形成後排出至血漿參加循環。
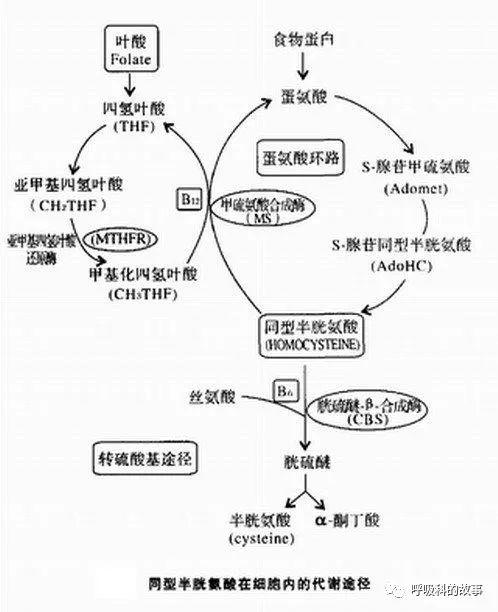
在同型半胱氨酸代謝過程中,維生素B12和葉酸起了重要的作用,Hcy合成和代謝途徑及其相關的酶系統、 葉酸、 維生素B12和維生素B6的缺乏、MTHFR、甲硫氨酸合成酶(MS)、CBS的缺陷都可引起高同型半胱氨酸血症 。由于維生素B12是蛋氨酸合成酶的輔酶,葉酸是體内甲基的供體,當兩者缺乏時可導緻MTHFR及CBS活性的降低,阻礙蛋氨酸的再生成,從而造成了Hcy在體内的蓄積。血清葉酸和維生素B12水平與血漿Hcy水平呈負相關關系,葉酸和維生素B12的水平越低,血漿Hcy水平越高。
除了同型半胱氨酸,第二個要介紹的是甲基丙二酸,這是個什麼物質呢?
人體進食蛋白質後,會分解成各種氨基酸,部分氨基酸代謝成丙酰輔酶A,繼續代謝成甲基丙二酶輔酶A,最後轉化成琥珀酰輔酶A。如果這條代謝途徑出了故障,則甲基丙二酰輔酶會變成甲基丙二酸。當人體内甲基丙二酸堆積後,會導緻一系列的病變,我們稱之為甲基丙二酸血症。
通常嬰兒一出生即可發病,患者臨床表現常無特異性,常常被誤診為一般圍産期腦損害、 敗血症、急慢性腦病或腦變性病,常見喂養困難、嘔吐、呼吸急促、驚厥、肌張力異常、嗜睡、智力、運動落後或倒退,急性期可見昏迷、呼吸暫停、 代謝性酸中毒、 酮症 、 低血糖、高乳酸血症、 高氨血症 、高甘氨酸血症、肝損害、腎損害,嚴重時腦水腫、腦出血。患者神經系統異常各不相同,多于嬰兒期出現智力、運動落後,肌張力低下,變位酶缺陷患者常較钴胺素代謝異常患者神經系統損害出現早,并且嚴重。少數钴胺素代謝異常所緻良性甲基丙二酸尿症患者可于成年後發病,甚至終身不發病。
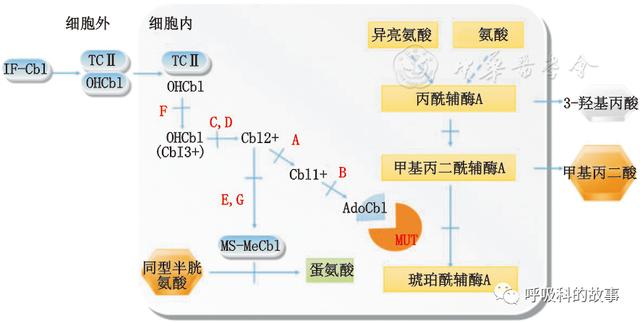
甲基丙二酸血症,屬于常染色體隐性遺傳。因為甲基丙二酰輔酶A變位酶(維生素B12無反應型)或輔酶腺苷钴铵缺乏(維生素B12反應型),導緻L-甲基丙二酸不能轉變為琥珀酸而在血中蓄積所緻。甲基丙二酸血症緻病機理包括兩種變位酶酶蛋白缺陷産生的完全性變位酶缺陷(mut0)和部分缺陷(mut-);兩種腺苷钴胺素(AdoCbl)合成缺陷,即線粒體钴胺素還原酶(cblA)缺乏和線粒體钴胺素腺苷轉移酶(cblB)缺乏;以及3種由于胞漿和溶酶體钴胺素代謝異常引起的腺苷钴胺素和甲基钴胺素(MeCbl)合成缺陷(cblC,cblD,cblF)。
Cbl-C缺陷是MMACHC緻病性突變引起的細胞内钴胺素代謝異常的一種罕見的先天性出生缺陷。MMACHC缺乏會影響膳食維生素B12轉化為其代謝活性形式,即甲钴胺和腺苷钴胺,導緻甲基丙二酸和同型半胱氨酸蓄積。
根據發病年齡,cbl-C缺陷分為早發型(12個月前發病)和晚發型(12個月後發病)。報告的患者中約90%早期發病嚴重,預後差。相比之下,很少有遲發病例報告。晚發型cbl-C缺陷患者通常表現較輕,除溶血性尿毒症(HUS)外,預後相對較好。認知障礙是cbl-C缺陷最常見的症狀,其次是脊髓病、共濟失調和癫痫發作。cbl-C缺陷的症狀與發病年齡密切相關。在學齡前兒童中,HUS和PH是主要症狀,而在大兒童/青少年中,精神症狀、認知障礙和共濟失調/構音障礙是最常見的表現。成人除認知功能下降和共濟失調/構音障礙外,血栓栓塞事件、神經病/脊髓病和非HUS腎病也是主要特征。
肺動脈高壓是cbl-C缺陷的一種嚴重而罕見的并發症。在成人中,僅報道過18歲的男性和20歲的女性被診斷為cbl-C缺陷合并PH,同時伴有嚴重腎血栓微血管病變和高血壓。Cbl-C缺陷合并PH以及彌漫性肺損害僅在少數兒童遲發病例中報道。因此,該患者可能是第一個以低氧血症、彌漫性肺損害和PH為主要表現的成人Cbl-C缺陷患者。該患者的罕見表現對于準确診斷是一個巨大挑戰,導緻準确診斷和治療的延遲。
cbl-C缺陷相關PH發病機制尚不清楚。既往研究表明,PH的主要原因與同型半胱氨酸和甲基丙二酸血症所緻的肺微血管病變有關。這些毒性代謝産物可能導緻内皮損傷,促進血管平滑肌的血管收縮和細胞增殖,增強血小闆聚集,從而形成微血栓,并導緻随後的肺血栓微血管病。此外,甲基丙二酸血症和高同型半胱氨酸血症并存,可能增加肺毛細血管通透性,導緻肺部彌漫性磨玻璃影改變。
針對cbl-C缺陷的治療主要是維生素B12、甜菜堿和葉酸的聯合補充。大多數晚發型cbl-C缺陷患者對這些治療的良好反應。據報道,大約20例晚發型cbl-C缺陷合并嚴重PH的患者接受了cbl-C治療和PAH靶向治療,包括單藥治療和聯合治療。經過2-3個月的治療後,大多數患者的臨床症狀和實驗室參數都有所改善,包括低氧血症和PH情況。根據文獻報道,經過6個月至1年的治療,部分患者肺動脈壓力恢複正常,但也有兒童在治療的第一個月死于右心衰竭。重要的是,如果沒有合适的cbl-C治療,僅PAH靶向治療的效果有限,這表明正确診斷PH病因對于選擇合适的治療至關重要。
Cbl-C缺陷是一種少見的PH病因,成人可出現嚴重PH和彌漫性肺部病變。該病例提示,在診斷PH時,應仔細進行代謝篩查,在鑒别診斷PH時應考慮代謝障礙所緻PH。
非常感謝上海肺科醫院肺循環科的王岚和趙勤華醫生供稿,版權所有,歡迎轉發,如有需要轉載請注明出處。
同時歡迎全國各地的同道将有好的病例報告均可與本公衆号聯系。
,更多精彩资讯请关注tft每日頭條,我们将持续为您更新最新资讯!