八隅規則(或稱八電子規則)指出,原子傾向于在其價殼層中具有 8 個電子,以便擁有類似于最接近惰性氣體的電子結構。

八隅規則是化學"經驗法則"之一,指出原子喜歡以這樣的方式組合,以至于每個原子的價殼層中都有8個電子。價殼是原子的外殼,外殼中的八個電子允許原子具有類似于最接近惰性氣體的配置,這反過來又使它們更加穩定。
為了在價殼層中具有8個電子,原子傾向于形成共價或離子鍵。離子鍵見氯化鈉或鹽,而共價鍵見二氧化碳(CO2)。鍵由原子形成,以減少反應,享受更多的穩定性。
為了理解原子如何以及為什麼在價殼層中需要8個電子才能處于穩定狀态,讓我們首先了解電子在原子中的分布方式。
電子是如何在原子中分布的?原子是元素中最小的粒子,然而,它内部卻有一個微觀宇宙。構成這個微觀宇宙一部分的3個亞原子粒子是中子、質子和電子。中子沒有淨電荷,位于原子的中心,以及帶正電荷的質子。中子和質子一起構成原子核。電子是負電荷粒子,繞着原子核旋轉。
電子和質子被電磁力相互吸引,電磁力是帶電粒子之間的物理相互作用。因此,将電子與原子核分離需要大量的能量。電子離原子核越近,分離它所需的能量就越高。
電子在名為K、L、M和N的不同殼中旋轉,從原子核開始向外擴展。每個逐行殼具有不同的能量級别,對應于 1、2、3 或 4。每個外殼可以包含的最大電子數為 2(n^2),其中 n 對應于能級。因此,K有2個電子[2(1)^2],L有8個電子,M有18個電子,N有32個電子。
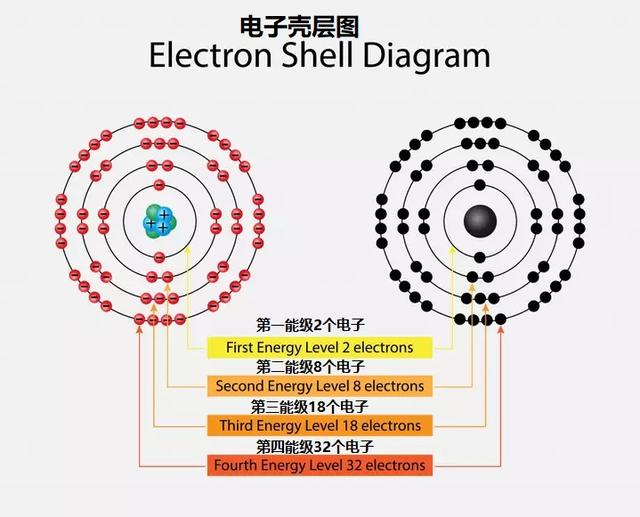
電子層或電子殼
此外,這些殼被分為含有原子軌道的子殼。殼包含從原子核開始的軌道,名為s、p、d和f。電子在殼和子殼中的排列稱為原子的電子配置。
外殼的數量會根據原子中存在的電子數量而增加。元素中最外層的外殼稱為價殼層,而發現的電子稱為價電子。
什麼是價殼層?
價電子導緻原子參與化學反應的傾向。一個裝有封閉外殼的原子,其價殼層中含有8個電子,被認為具有化學惰性,因為它幾乎不參與化學反應。然後,這些元素的原子将具有類似于惰性氣體的電子結構。
周期表是一個表格排列,包含按其電子配置、性質和原子數排列的所有已知元素。在表格的最右邊是稱為惰性氣體的元素組。它們被認為是穩定的元素,因為它們有一個完全填充的價殼層。這6種惰性氣體是氦(2)、氖(10)、氩(18)、氪(36)、氙(54)和放射性元素氡(86),每個括号内的數值表示元素的原子序數。
惰性氣體是反應最少的,因為它們的外能級已經充滿。8個電子在其外殼的存在使惰性氣體的價值為零。其他反應原子往往通過遵循八隅規則來填充其外殼,以接近惰性氣體的穩定性。
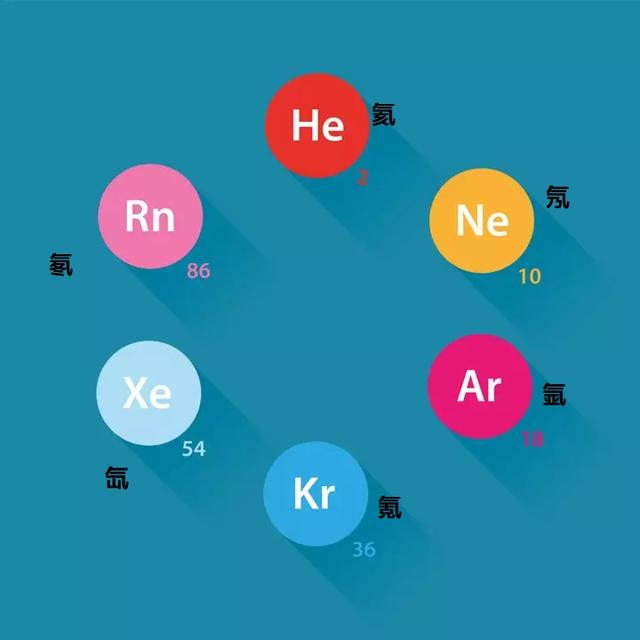
惰性氣體
八隅規則隻考慮 s 和 p 子殼中存在的電子。這些子殼可以容納最多8個電子在其最外層的外殼。
你可以認為價電子是原子擁有的一些最重要的電子,因為它們是位于最高能量水平的電子。這些是最常見的參與化學反應的電子。可以使用劉易斯電子點結構計算價電子。
劉易斯的結構以吉爾伯特·劉易斯的名字命名,他于1916年首次在他的文章《原子與分子》中引入了這個概念。劉易斯結構隻代表價電子,這些電子被标識為原子周圍的點,每個點代表一個價電子。大多數時候,其價殼中電子少于8個的原子傾向于通過共價鍵或離子鍵形成化合物。
這種鍵的形成可以滿足八隅規則。周期表第二組的元素通過在原子之間丢失、獲得或共享電子來滿足8個電子的标準。
形成的鍵的類型取決于價殼中的電子數量,以及形成該鍵所需的總能量。LEDS 幫助我們确定有多少自由電子可用于化學反應。
什麼是共價鍵?共價鍵是兩個原子之間的連接,允許它們之間共享電子,這樣每個原子都有類似于最接近惰性氣體的電子結構。
以二氧化碳為例:碳和氧的原子序數分别為6和8。碳有2個殼,K和L,在K殼中有2個電子,在L殼中留下4個電子。為了達到穩定性,碳要麼會失去所有4個電子,最接近氦氣,要麼獲得4個電子,最接近氖。由于質子和原子核中電子之間的吸引力,獲得或失去4個電子所需的能量是巨大的。然而,中間地帶的選擇是共享其電子。
同樣,氧氣在K殼中有2個電子,在L殼中有6個電子。它隻需要2個電子是穩定的,并達到類似于氖的電子配置。獲得2個電子比失去4個電子更容易(這将使它類似于氦)。作為調整,2個氧原子喜歡用一個碳原子共享其電子,這樣所有三個原子的價殼中都有8個電子,并且各自穩定。
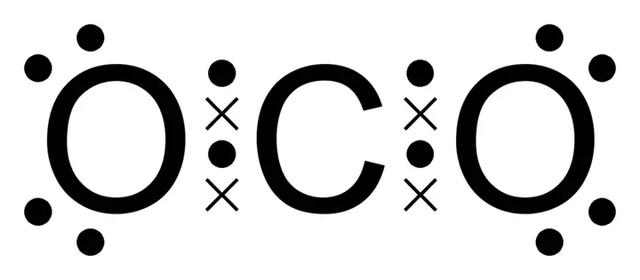
顯示 CO2 的劉易斯點結構。x代表碳的電子,點代表氧電子。
其結果是形成一個具有一個碳原子和2個氧原子的二氧化碳分子,每個原子在它們的價殼層種各自具有8個電子。
什麼是離子鍵?離子鍵是一種發生在相反電荷離子之間的化學鍵。原子可以是正電荷,也可以是負電荷,這取決于原子過量的質子或電子的數量。由于電子的增益或損耗,電子是具有淨電荷的原子。請記住,電子帶負電荷,如果一個原子獲得一個電子,它将有負電荷,但如果它失去了一個電子,它将有一個正電荷。簡而言之,電子是包含特定電荷的原子。
金屬與非金屬之間發生離子鍵,其中一種是電正的,另一種是電負的。電正金屬失去電子,變成正離子,稱為陽離子,而電負非金屬接受電子,成為負電荷離子,稱為陰離子。電子的損耗和接受是相同的,以形成離子鍵,同時,每個原子滿足八隅規則!
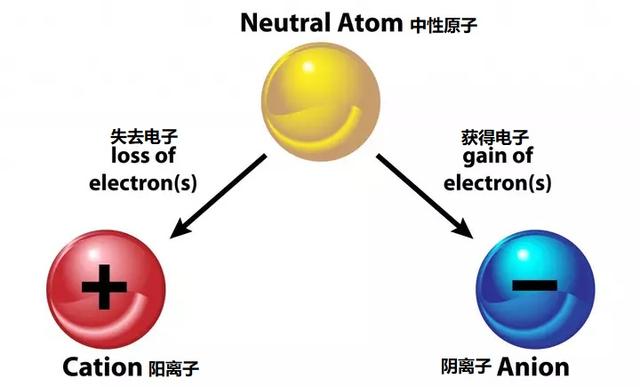
陽離子與陰離子
因此,當一個原子的電子和質子數量不等時,它被稱為一個離子。結果,2個電荷不相等的原子通過失去或獲得電子而走到一起,從而通過離子鍵達到中性電荷。它們借助于它們之間的吸引力保持鍵合。最終的結果是每個原子都是穩定的,因為它有一個完全充滿8個電子的價殼層。
鹽或氯化鈉是離子鍵的一個很好的例子。鈉的原子數為11,K、L和M殼中分别有2、8和1個電子。這在價殼中留下1個電子,鈉原子在反應中很容易丢失。氯的原子數為17,K、L和M殼中為2、8和7電子。氯的價殼有7個電子,因此具有很強的電負。每個原子隻需要調整1個電子,有一個完全填充的價殼層,并達到一個類似于最接近惰性氣體的配置。

氯化鈉(鹽)中的離子鍵合
在鈉或氯的情況下,獲得或失去7個電子所需的能量是巨大的。為了使這個過程更容易,鈉失去了它孤獨的電子,并獲取了類似于氖(10)的電子配置。氯接受鈉丢失的電子,并實現類似于氩(18)的電子配置。最終結果是鈉和氯之間的離子鍵,形成穩定的化合物,也就是我們日常吃的鹽。
我敢打賭,你從來沒有想過,日常的食鹽竟然有如此複雜的化學經曆!
八隅規則的例外情況是什麼?有一些元素不遵循八隅規則的示例,讓我們簡單看一下它們。
電子奇數的分子通常不遵循八位字節規則。此外,隻有2個電子(總數)的原子屬于這一類。
原子序數為1的氫原子最多可以容納2個電子,但這些原子隻有一個帶s軌道的電子外殼。由于八隅規則僅适用于 s 和 p 軌道,因此具有 2 個電子的原子是該規則的例外。另外,一個或多個原子具有多或少于8個電子的分子也是例外。
八隅規則是化學中最重要的規則之一,它控制原子如何相互作用以在其價殼層種容納8個電子,形成共價鍵或離子鍵是原子滿足八隅規則的最方便的方法。畢竟,原子可能厭倦了一直處于反應狀态,而遵循八隅規則隻是為了獲得穩定!
,更多精彩资讯请关注tft每日頭條,我们将持续为您更新最新资讯!




