尿石症是影響人類的最常見疾病之一,與多種泌尿系統并發症有關 [ 1 ]。據報道,草酸鈣 (CaOx) 會損傷培養的腎小管細胞,之後細胞膜磷脂酰絲氨酸 (PS) 在體外從内層翻轉到外層,在腎結石形成中發揮重要作用 [ 2 ]。在細胞水平上進行的各種研究 [3-6 ]也報道了類似的發現。然而,由 CaOx 介導的損傷引起腎小管細胞 PS 外化的潛在機制仍不清楚。先前的研究表明,高濃度的草酸鈣會導緻活性氧 (ROS) 的過量産生 [ 7],随後有助于 PS 在腎小管細胞中的外化,導緻 CaOx 晶體的成核和生長 [ 8 ]。ROS 和脂質過氧化作用強烈激活磷脂加擾酶 (PLSCR) [ 9 ],而暴露于 ROS 清除劑,如谷胱甘肽、輔酶 Q10 或艾地苯醌(一種合成輔酶 Q10 同系物),會降低 PLSCR 在多囊腎病中的激活 [ 10 ] . PLSCR 固定在細胞膜上 [ 11 ],作為三種磷脂翻轉酶之一發揮作用,能夠催化 PS 在膜兩側沿濃度梯度快速雙向移動 [ 12 ]]. 在生理條件下,細胞膜處于不對稱狀态,PLSCR對細胞膜無影響[ 13 ]。然而,在真核細胞受傷後, PLSCR被激活并将 PS 從内層移動到外層 [ 14、15 ]。此外,據報道,PLSCR 在中國倉鼠卵巢 K1 細胞中的過表達會刺激 PS 外化,從而在細胞凋亡過程中增強 PS 向細胞表面的向外運動 [ 16 ]。因此,我們假設 PLSCR 也通過激活 ROS 參與腎小管細胞膜中的 PS 外化。
草酸鹽誘導 ROS 産生的潛在分子機制是通過誘導 TGF-β1/Smad 信号傳導發生的,這可能在 ROS 的産生中發揮作用 [ 17、18 ]。事實上,據報道,TGF-β1/Smad 信号轉導涉及多種腎髒疾病,例如腎小球腎炎、腎間質纖維化和腎結石 [ 19 ]。此外,用 TGF-β1 處理的單核細胞通過導緻 PS 從内層翻轉到外層,在細胞膜中表現出 PS 外化 [ 20 ]]. 然而,據我們所知,TGF-β1/Smad 信号與腎小管細胞膜中 PS 外翻之間的關系仍然未知。我們假設 TGF-β1 在 ROS 介導的大鼠腎結石形成早期通過激活 PLSCR 參與腎小管細胞膜的 PS 外翻。
因此,我們研究了TGF-β1/Smad信号是否通過ROS激活刺激PS外化以及TGF是否在體外和體内腎結石發展的早期激活腎小管細胞膜中的PLSCR,從而為病因學奠定理論基礎腎結石的形成。
草酸鈣介導的損傷後腎小管細胞磷脂酰絲氨酸外翻的機制仍不清楚;因此,我們研究了 TGF-β1/Smad 信号轉導對腎結石形成早期腎小管細胞膜磷脂酰絲氨酸外翻的影響。大鼠早期草酸鈣結石模型,流式細胞儀檢測腎小管細胞膜磷脂酰絲氨酸外翻,腎組織TGF-β1(轉化生長因子-β1)、Smad7、磷脂混雜酶的表達通過蛋白質印迹法測量腎小管細胞膜。我們觀察到 TGF-β1/Smad 信号通路增加了生物體水平的磷脂酰絲氨酸外翻。
體外研究結果表明,草酸鹽暴露于腎小管細胞會誘導 TGF-β1 表達,增加磷脂加擾酶活性和腎小管細胞膜中的磷脂酰絲氨酸外翻。這些結果表明,在腎結石發展的早期階段,TGF-β1 通過增加腎小管細胞膜中的磷脂加擾酶活性來刺激磷脂酰絲氨酸外翻。這項研究的結果為進一步詳細研究開發專門治療尿路結石并産生較少副作用的治療劑奠定了基礎。
讨論迄今為止,動物研究既沒有關注 PS 在腎結石形成中的作用,也沒有解決體外研究的結果是否适用于動物。為了獲得更可靠的結果,最好使用體外模型進行研究。在我們的早期 CaOx 結石大鼠模型中,腎結石組的 TGF-β1 水平和 PS 外翻率增加,這與在細胞水平上獲得的結果一緻,表明随着草酸濃度的增加,伴随增加在細胞膜中-PS 外翻允許晶體粘附在細胞膜上 [ 28]. 因此,我們證實上述細胞學研究适用于檢查大鼠模型。我們發現草酸鹽本身對細胞有害,它可能作為上調 TGF-β1 的主要藥物。此外,SB431542 顯着抑制了 TGF-β1 水平和 PS 外化,表明 TGF-β1/Smad 信号通路促進了生物體水平的 PS 外化。通過誘導 TGF-β1 逐步激活腎小管細胞中的 NAD(P)H 氧化酶,是 TGF-β1/Smad 信号誘導 ROS 産生的潛在分子機制 [ 7 ],而 ROS 介導 MRP-1 或BCRP 在草酸鹽誘導的腎上皮細胞膜 PS 外化中起關鍵作用 [ 23 ]]. 因此,我們得出結論,TGF-β1/Smad 信号誘導腎小管上皮細胞 PS 外翻的機制是通過 ROS 引起的氧化應激介導的。
當 LLC-PK1 細胞用 1 mmol 草酸鉀 (KOx) 處理 6、12、24 或 48 小時時,Khan 等人。草酸鹽處理 6 小時後,未檢測到細胞發生顯着的凋亡形态學變化。然而,在暴露 12 小時後,他們觀察到顯着的細胞凋亡變化,包括核染色質的濃縮和邊緣化、DNA 片段化以及質膜雙層中的 PS 從内部遷移到細胞表面 [ 8 ]。在我們之前的研究中,我們發現 0.5 mmol 草酸鹽導緻 MDCK 腎上皮細胞系中 PS 外化的時間和濃度依賴性增加 [ 2]. 在這項研究中,将 0.5% CaOx 應用于細胞,腎結石組的 PS 外翻率增加。盡管在我們目前的研究中細胞膜 PS 翻轉,但這些細胞不應該發生凋亡。PS 外翻是細胞凋亡的重要表面标志物。最近的研究表明,細胞凋亡和 PS 外翻是兩個獨立的事件,即凋亡細胞不一定表現出 PS 外翻,PS 外翻細胞也不一定發生凋亡 [ 29 ]。僅依靠 PS 外翻來确定細胞是否凋亡是不合适的,因為研究報告了非凋亡細胞中的 PS 暴露[ 30-32 ]。
在這項研究中,在對照組細胞中檢測到的 PLSCR 水平可忽略不計,而這種蛋白質在 CaOx 組中顯着增加,表明 PLSCR 過表達。這些結果與 Singireesu 等人的發現一緻。關于 DHCL 對腎細胞的潛在毒性作用 [ 33]. 當 CaOx 組細胞經抗 TGF-β1 抗體處理後,PLSCR 水平顯着降低,表明 PLSCR 的激活是由 TGF-β1 介導的。此外,我們觀察到 TGF-β1 組和 CaOx 組 NBD-PS 的向外運動增強。當用 PLSCR siRNA 轉染來自這些組的腎小管上皮細胞時,PS 内化率增加,而外化率降低,表明 TGF-β1 通過激活腎小管細胞膜中的 PLSCR 引起腎小管細胞膜中的 PS 外化。體外。總之,草酸鹽暴露于腎小管細胞會誘導 TGF-β1 表達,從而通過 NAD(P)H 氧化酶增加 ROS 的産生;然後 ROS 改變 PLSCR 的活性 [ 9 , 10]. 最後,PLSCR 導緻腎小管細胞膜中的 PS 外化,如我們的研究所示。
之前的一項研究表明,草酸鹽處理不會在體外激活 MDCK 細胞中的 PLSCR,因為 PLSCR 激活需要增加細胞質 Ca 2 ,而草酸鹽會迅速降低 MDCK 細胞中的細胞内 Ca 2 濃度 [ 2 ]。本研究的結果支持這一假設。也就是說,雖然之前的研究證明了草酸而不是 CaOx 對腎小管上皮細胞的影響,但我們發現在大鼠模型中 CaOx 結石形成的早期階段,腎集合系統中的 Ca 2 濃度增加. 由于 PLSCR 暴露在細胞膜外,我們認為 PLSCR 可能被 Ca 2 激活在腎集合系統中而不是通過細胞内 Ca 2 。
在生理條件下,真核細胞膜中磷脂的不對稱分布需要氨基磷脂轉位酶(APLT)和 PLSCR 發揮協同作用,是細胞膜發揮其生理功能所必需的 [ 34 ]。在這個實驗中,我們考慮了細胞膜中 PS 外翻的比率來指示 PLSCR 的活性。由于APLT已被證實為導緻PS外翻的因素之一,因此APLT影響了本實驗中PLSCR酶活性的測定。需要進一步的臨床研究來驗證 APLT 和 PLSCR 如何在腎小管細胞膜的 PS 外翻中協同作用,并确定控制 PS 外翻的其他因素以更好地了解腎結石形成的潛在機制。
結論CaOx 暴露可以增強 TGF-β1 的上調,從而激活腎小管細胞中的 ROS;然後 ROS 強烈激活 PLSCR,這是 TGF-β1-ROS 信号在腎結石形成的早期階段刺激腎小管細胞膜中 PS 外化的主要機制之一。這項研究的結果為進一步詳細研究開發專門治療尿路結石并産生較少副作用的治療劑奠定了基礎。
圖1
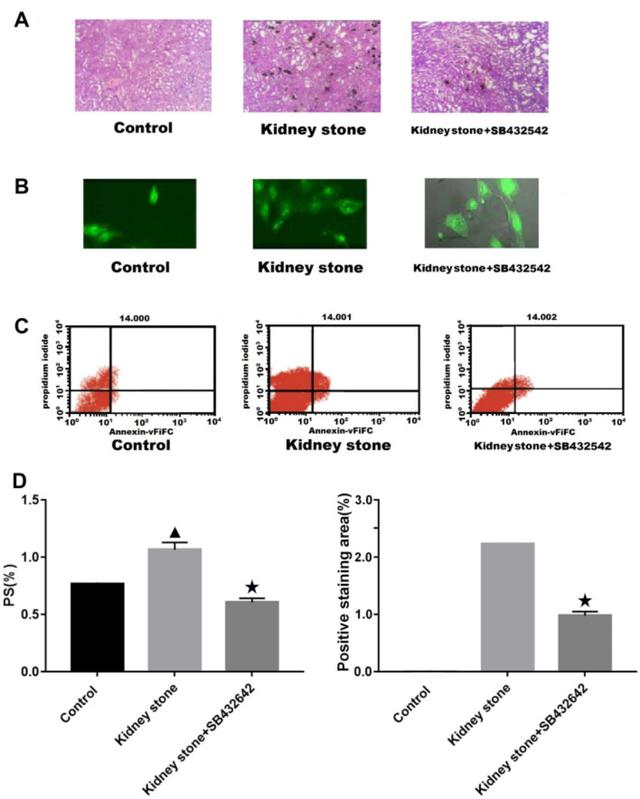
在對照組、腎結石和腎結石 SB431542 組中觀察到晶體形成和 PS 外化。( A) 第 14 天腎組織中的晶體形成;箭頭表示微晶結構。(B) 共聚焦激光顯微鏡觀察到的 MDCK 細胞。(C) 外翻率的流式細胞術圖。(D) 外翻率 (%)。三角形表示與對照相比P< 0.05。星号表示 與腎結石組相比P < 0.05
Gan XG, Xu HT, Wang ZH. Phosphatidylserine eversion regulated by phospholipid scramblase activated by TGF-β1/Smad signaling in the early stage of kidney stone formation. Urolithiasis. 2022 Feb;50(1):11-20. doi: 10.1007/s00240-021-01292-0. Epub 2021 Dec 3. PMID: 34860265; PMCID: PMC8784500.
,更多精彩资讯请关注tft每日頭條,我们将持续为您更新最新资讯!




