
類型一 pH變化曲線
原理分析
圖像
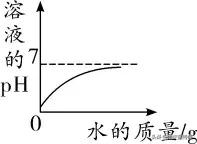
酸的稀釋:
開始時,溶液的pH<7,随着水的加入,酸性不斷減弱(pH不斷增大),但溶液始終為酸性,pH不會大于或等于7,隻會無限接近7
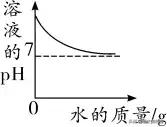
堿的稀釋:
開始時,溶液的pH>7,随着水的加入,堿性不斷減弱(pH不斷減小),但溶液始終為堿性,pH不會小于或等于7,隻會無限接近7
2. 酸堿中和反應
原理分析
圖像
酸入堿:
開始時溶液呈堿性,pH>7,随着酸的加入,pH逐漸減小,當酸堿剛好完全反應時,pH=7,溶液呈中性;随着酸的繼續加入,溶液的pH<7,溶液呈酸性

堿入酸:
開始時溶液呈酸性,pH<7,随着堿的加入,pH逐漸增大,當酸堿恰好完全反應時,pH=7,溶液呈中性;随着堿的繼續加入,溶液的pH >7,溶液呈堿性

類型二 化學反應中物質質量的變化曲線
(1)不完全反應
原理分析
圖像
随着反應的進行,反應物的質量不斷減小,當減小到一定程度後反應停止,質量保持不變,反應物有剩餘

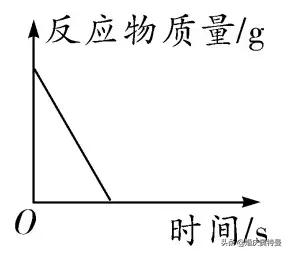
(2)完全反應
原理分析
圖像
随着反應的進行,反應物的質量不斷減小,直到反應停止,反應物沒有剩餘
2. 生成物的質量變化
(1)兩種物質之間的反應
原理分析
圖像
随着反應的進行,生成物的質量不斷增大,恰好完全反應時,生成物的質量達到最大,之後,生成物的質量将不再改變

(2)一種物質和兩種物質反應且存在優先反應
第一個反應的生成物反應時立即産生,起點為原點,随着反應的進行,第一個反應的生成物的質量逐漸增大,達到最大值時第一個反應結束(如圖1);
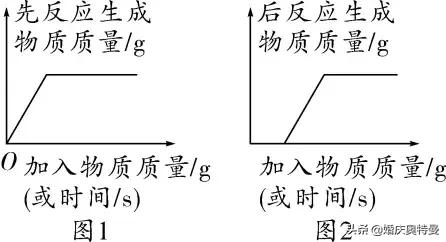
第二個反應在第一個反應結束時開始,時間起點不為原點,随着第二個反應的進行,第二個反應的生成物的質量逐漸增大,達到最大值時第二個反應結束(如圖2)。
【知識拓展】優先反應原則:
①H+優先與OH-發生反應(或OH-優先與H+發生反應)
舉例1:将NaOH溶液加入到CuSO4和H2SO4的混合溶液中
先:2NaOH+H2SO4 Na2SO4+2H2O
後:2NaOH+CuSO4 Na2SO4+Cu(OH)2↓
舉例2:将鹽酸加入到NaOH和Na2CO3的混合溶液中
先:NaOH+HCl NaCl+H2O
後:Na2CO3+2HCl 2NaCl+H2O+CO2↑
②碳酸鹽和混合溶液的反應: 優先與H+發生反應
舉例:将碳酸鈉加入到氯化鈣和稀鹽酸的混合溶液中
先:Na2CO3+2HCl 2NaCl+H2O+CO2↑
後:Na2CO3+CaCl2 CaCO3↓+2NaCl
【特别提醒】将稀硫酸加入到NaOH和Ba(NO3)2的混合溶液中,由于H+、 、Ba2 、OH-均隻發生一個化學反應,所以不存在先後順序,生成沉澱和酸堿中和是兩個獨立的過程,反應開始,兩個反應同時發生。
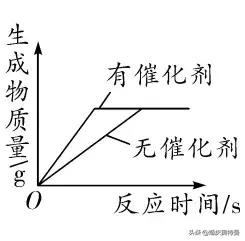
(3)加入催化劑時,生成物的質量變化
原理分析
圖像
反應時加入催化劑,催化劑隻能改變化學反應的速率,但不影響生成物的質量
【知識拓展】催化劑的質量變化
原理分析
圖像
催化劑在化學反應中隻起到改變反應速率的作用,其質量在化學反應前後不發生變化

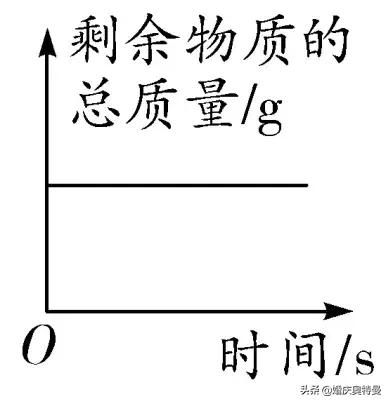
3. 反應後剩餘物質(元素)的質量變化
原理分析
圖像
沒有氣體參與或生成的反應,剩餘物質的總質量與反應物的總質量相等;在密閉容器内有氣體參與或生成的反應,剩餘物質的總質量與反應物的總質量也相等
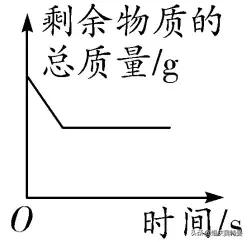
原理分析
圖像
在非密閉容器中的反應:有氣體參與而沒有氣體生成的反應,反應後剩餘物質的總質量增大(增加的為參與反應的氣體質量)

在非密閉容器中的反應:沒有氣體參與而有氣體生成的反應,反應後物質的總質量減小(減小的為生成氣體的質量)
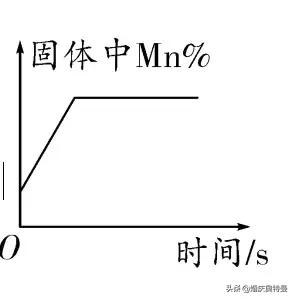
原理分析
圖像
首先判斷該元素會不會減少(即生成的氣體中是否含該元素),當元素不存在于生成的氣體中時,剩餘固體中該元素的質量不變,剩餘固體質量減小,故該元素的質量分數逐漸變大(起點不為原點),當反應結束時,不再變化,如加熱一定質量的氯酸鉀和二氧化錳時,錳元素的質量分數變化
更多精彩资讯请关注tft每日頭條,我们将持续为您更新最新资讯!




