撰文:何政達 所屬專欄:理論化學研習社

一、前言:
上次我們講到了化學反應機理以及基元反應。現在我們需要從更深入的層次上理解化學反應的過程。那麼首先,我們先思考一下,化學反應是怎麼發生的?當然,要了解這個問題之前。我們必須問問自己:化學反應如何進行分類?如果我們從不同角度來看待這個問題,就會得到不同的解答。比如,如果從是否轉移電子的角度分析,我們可以将化學反應分成氧化還原反應、非氧化還原反應。如果從反應物和産物的關系來進行分類,可以分成四類:化合反應、分解反應、置換反應與複分解反應。當然,如果按照反應物的種類來分,也可以将化學反應分成無機化學反應、有機化學反應。總而言之,運用不同的分類标準,我們可以從許多側面對化學反應進行初步了解。自然我們也可以知道,化學反應的種類繁多且十分複雜,因此如何找到一個簡單的模型來對其進行研究,就變得十分重要。在本文中,我們希望介紹一個最簡單的化學反應模型——過渡态理論 。讓大家對現在如何研究化學反應有個最初步的了解。
圖1最簡單的化學反應過程示意圖。橫坐标反應坐标為反應進程的表述,縱坐标為體系能量值。
當反應體系處于反應物狀态時,它處于穩定狀态。體系能量已經達到了極小值。由于周圍環境的熱擾動(也可以稱為外界環境漲落),将反應物體系的能量升高。這時有些化學鍵開始松動。我們知道化學鍵的存在意味着體系能量的降低,但是化學鍵松動就代表着體系能量開始提高。當體系能量提高到一定程度時(從圖1中,指的是活化能:Activation energy),體系有一定概率出現新的化學鍵,而原來舊的化學鍵開始斷裂。這時新的化學鍵開始生成、舊的化學鍵繼續斷裂(但這時斷裂的化學鍵對能量的貢獻已經比較小了),體系的能量由新生成的化學鍵控制,整個體系能量降低。最終當舊鍵完全斷裂、新鍵完全生成的時候,這時體系達到了産物狀态。我們稱這個過程為化學反應過程,也就是反應體系從反應物狀态變化到了産物狀态。從上面的分析中我們可以得到以下幾點啟示:
反應物狀态和産物狀态都是化學體系的穩定狀态(不一定是全局最穩定,而是局域穩定狀态)
在反應物到産物的過程中,需要經過至少一個能量極大值點。這個點的能量與反應物能量之差,我們稱為活化能。這是化學反應中十分重要的一個物理量。可以通過第一性原理計算來得到。
從反應物到産物中,至少有一條路徑連接它們。在真實體系中,連接反應物和産物之間的可能有多條路徑。每條路徑都有自己的活化能與反應坐标。然而它們也都有一定的發生概率,如何判斷哪條反應路徑是真實情況?或者說它們在某種特定情況下都有可能?這些問題是研究化學反應必須要回答的。
從上面的描述中我們也可以推測出催化劑的化學作用:通過将反應物吸附在催化劑上,從而改變了反應物、産物的能量,同時也改變了中間态(過渡态)的能量。甚至有時還有可能改變反應路徑。這也是為什麼催化化學是化學中十分重要的一個分支。當我們設計出了好的催化劑以後,我們就可以控制化學反應按照我們的需求(反應性、選擇性、适宜的外界條件等等)而進行。
三、過渡态理論
上面我們給出了理解化學反應的一個思維模型。但是這個模型有一些缺陷:(1)它不能給出定量化的描述(2)真實的反應過程可能比上面講到的複雜得多(見圖2)。下面我們試圖解決第一個問題,第二個問題是目前研究化學反應(物理化學/理論化學/計算化學學科)當中很大的問題,我們将會在以後的文章中着重講述這個方向。
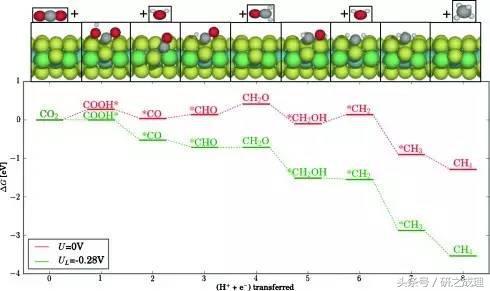
圖2. CO2還原反應的反應路徑(真實體系)
我們下面要介紹的理論稱為過渡态理論,是Erying最先提出的(其本人照片見圖3)。Erying提出了一種不同的思考化學反應的方式(當然下面的推導都基于圖1中的簡單化學反應模型而言的)。Erying認為,一個化學反應體系分成三個區域:(1)反應物區(2)過渡态區(3)産物區。

圖3. Henry Erying站在黑闆前介紹他自己建立的過渡态理論
在Erying過渡态理論當中認為:
反應物區和過渡态區之間的轉換已達到平衡狀态。
隻要反應體系達到過渡态區,那麼就認為發生一次化學反應。
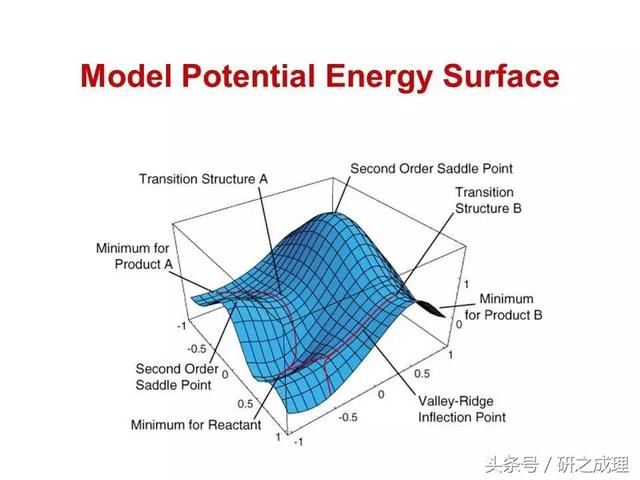
過渡态處于一階鞍點位置。具體的數學含義就是:隻在一個方向上(反應路徑)該點具有極大值,而在其他方向上都是極小值。我們認為在這條路徑上體系的運動是十分緩慢的,而在其他方向上體系都已達到穩态,隻是在做局部振動 。
圖4. Erying過渡态理論中勢能面的示意圖
根據上面三條假設,再加上一些統計物理的知識,我們就可以推出Erying過渡态理論的公式:
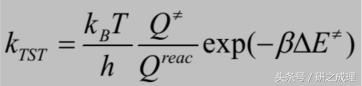
下面是簡單的推導過程:
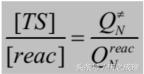
其中的N代表體系總共的自由度。那麼我們就可以得到:
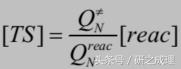
根據假設2,化學反應發生的條件是體系達到過渡态區域。既然我們已經有了過渡态區域中所包含體系的量,隻要我們知道通過過渡态區域的頻率,根據速率=頻率*物質的量,我們就可以計算出來化學反應的速率。這時Erying用了一些小技巧。他将過渡态區域認為是一個有固定長度δ的區域。而根據假設3,在某一個路徑上體系具有極大值(過渡态),且這個路徑上體系變化較慢,因此體系在該路徑方向上通過過渡态區域的頻率可以寫成:

在這裡我們需要解釋一下符号。QN0,≠代表已經将體系基态能量提取出來後的配分函數,且這時此配分函數擁有全部N個自由度。在後一步的處理當中,我們将該N個自由度分成兩份:N-1以及1:

因此将上面的式子整理一下,我們就可以得到Erying的過渡态理論公式:

根據統計力學我們可以将配分函數Q寫成平動、振動、轉動的配分函數乘積。這些細節在之後的文章中會繼續給大家介紹。
本文初步給出了化學反應的分類,給出了一個化學反應最簡單的解釋,接着闡述了Erying的過渡态理論。關于Erying過渡态理論的最新進展以及其中所含有的問題,我們将在下一篇文章中詳細讨論。
祝學習愉快!
相關内容鍊接:
1.催化理論模型發展簡史
2.微觀動力學解合成氨催化反應TOF
,更多精彩资讯请关注tft每日頭條,我们将持续为您更新最新资讯!