物質的除雜(分離)作為中考化學必考題目之一,多以選擇填空的形式考查,下面小編将物質的除雜(分離)作為一個專題彙總相關知識,以方便大家的學習。

一、除雜原則
1. 不減:被提純的物質不能和加入的試劑反應。
2. 不增:不引入新雜質。
3. 易分:操作簡便易行,雜質易分離除去。
4. 複原:被提純物質易被複原。

二、除雜的常用方法
1. 物理方法
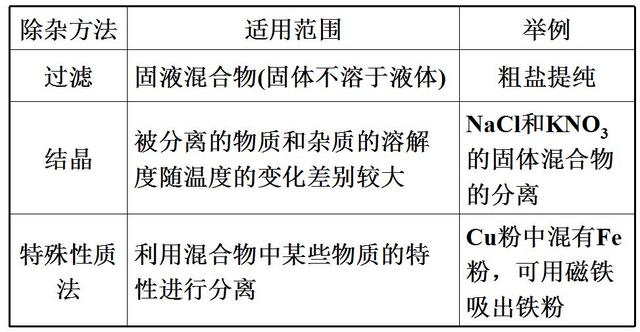
2. 化學方法

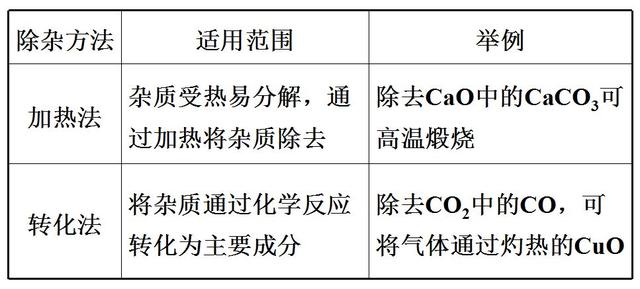


三、常見物質的除雜
1. 氣體的除雜
物質狀态
依據
舉例
主物質為酸性或中性氣體,雜質為水蒸氣
依據:濃硫酸具有吸水性
CO2/H2/O2(水蒸氣)
——通過濃硫酸
主物質為中性氣體(如CO、O2、N2),雜質為酸性氣體(如CO2)
依據:堿溶液能與酸性氣體反應
CO/N2/O2(CO2)——先通過氫氧化鈉溶液,再通過濃硫酸
雜質為具有還原性的氣體(如CO、H2)
依據:雜質氣體具有還原性
CO2(CO/H2)——通過灼熱的氧化銅,再通過濃硫酸
【補充】其它氣體的除雜方法:
(1)N2(O2)——通過灼熱的銅網
(2)CO2(HCl)——通過飽和碳酸氫鈉溶液,再通過濃硫酸
(3)H2(HCl)——先通過氫氧化鈉溶液,再通過濃硫酸或堿石灰

2. 固體的除雜
(1)固體和雜質均不溶于水
物質狀态
依據和方法
舉例
兩種金屬,其中主物質為不活潑金屬,雜質為活潑金屬
依據:金屬活動性順序
方法:加入足量的稀酸(稀鹽酸或稀硫酸),過濾
Cu(Fe)——加入足量的稀硫酸或稀鹽酸,過濾
兩種金屬,其中雜質的金屬活動性強于主物質
依據:金屬活動性順序
方法:加入足量的較不活潑金屬的鹽溶液
Fe(Zn)——加入足量硫酸亞鐵溶液,過濾;
Ag(Cu)——加入足量的硝酸銀溶液,過濾
金屬氧化物中含有其金屬單質
依據:金屬能與氧氣反應
方法:将所含的金屬氧化
CuO(Cu)——在空氣中(或氧氣流中)灼燒混合物
金屬氧化物中含有碳單質
依據:碳能在氧氣中燃燒
方法:在氧氣流中加熱,使碳燃燒
CuO(C)——在氧氣流中加熱
主物質為非金屬單質或氫後金屬單質,雜質為氫前金屬單質
依據:活潑金屬能與酸反應
方法:加入足量的稀酸(稀鹽酸或稀硫酸),過濾、幹燥
C(Fe或Zn)——①加入過量稀酸(稀鹽酸或稀硫酸)充分反應、過濾、幹燥
②當雜質為鐵時,也可以用磁鐵吸引
(2)固體(或固體中的雜質)溶于水
①主物質不溶于水、雜質能溶于水
方法:加水溶解、過濾、幹燥
如:MnO2(KCl)——溶解、過濾、幹燥
CaCO3(CaO或CaCl2)——溶解、過濾、幹燥
②主物質溶于水,雜質不溶于水
方法:加水溶解、過濾、蒸發結晶
如:NaCl(泥沙)——溶解、過濾、蒸發結晶
③特殊:CaO(CaCO3)——高溫煅燒


(5)确定除雜試劑:将确定的陰陽離子結合,即HCl、CaCl2、BaCl2,再結合易分離,可以選擇的除雜試劑是HCl。
【特别提醒】(1)首先考慮物理方法,再考慮化學方法。
(2)若有多種方法能除去雜質,要選擇步驟簡單、除雜最徹底的方法。(3)應盡量選擇既能除去雜質又能增加主物質的方法。

例下列除去雜質的方法中,合理的是( )
選項
物質
雜質
除雜方法
A
CO
CO2
通入足量的NaOH溶液後,幹燥
B
NaCl溶液
NaOH
加入适量稀硫酸
C
鐵粉
銅粉
加入足量稀硫酸,過濾
D
CaO
CaCO3
加入适量稀鹽酸,過濾

答案為A
2. 除去下列物質中混有的少量雜質(括号内為雜質),拟定的實驗方案不可行的是( )
A.NaCl溶液(MgCl2)——加入過量的NaOH溶液,過
濾,濾液中加稀鹽酸至中性
B. 氧氣(水蒸氣)——通過裝有足量無水氯化鈣的幹
燥管
C. CaO固體(CaCO3)——高溫充分煅燒
D. 氫氣(氯化氫氣體)——依次通過足量的NaHCO3溶液和濃硫酸
【解析】氯化鎂與氫氧化鈉溶液反應生成氫氧化鎂沉澱和氯化鈉,過濾可除去氫氧化鎂沉澱,濾液中加稀鹽酸至中性可除去反應剩餘的氫氧化鈉,得到氯化鈉溶液,A方案可行;無水氯化鈣具有吸水性,可除去氧氣中混有的水蒸氣,B方案可行;碳酸鈣高溫分解生成氧化鈣和二氧化碳,采用高溫煅燒的方法可除去氧化鈣中混有的碳酸鈣,C方案可行;氯化氫氣體溶于水得到鹽酸,碳酸氫鈉溶液與鹽酸反應生成氯化鈉、水和二氧化碳,經過濃硫酸幹燥後可得到氫氣、二氧化碳的混合氣體,除去了雜質氯化氫,但引入了新雜質二氧化碳,D方案不可行。
3. 除去下列各種物質中混有的少量雜質,所用的試劑或操作方法不合理的是( )
選項
物質
雜質
試劑、方法
A
稀硝酸
稀鹽酸
适量的硝酸銀溶液,過濾
B
木炭粉
鐵粉
用磁鐵吸引
C
二氧化碳
一氧化碳
點燃
D
氧化銅
銅粉
空氣中灼燒
A
√
硝酸銀能與稀鹽酸反應生成氯化銀白色沉澱和稀硝酸,過濾能除去氯化銀且沒有引入新雜質,符合除雜原則
B
√
鐵能被磁鐵吸引,可以将雜質除去,符合除雜原則
C
×
大量二氧化碳氣體中混有少量的一氧化碳,不能被點燃,不符合除雜原則
D
√
銅在空氣中灼燒生成氧化銅,可除去雜質,符合除雜原則
4.為了适應各種不同的需要,常常要把混合物進行提純:
(1)含有泥沙的粗鹽可通過溶解、_____、蒸發等處理,得到初步提純。其中在蒸發操作中玻璃棒的作用是_____,當蒸發皿中_____________時,停止加熱。
(2)除去銅粉中混有的少量鐵粉,可采用的物理方法是__________。除去氫氧化鈉溶液中的碳酸鈉,可以加入适量的_______________________________________________溶液,然後過濾。
【解析】(1)過濾可除去粗鹽中的難溶性雜質;蒸發結晶過程中需要使用玻璃棒攪拌,防止局部過熱導緻液滴飛濺;當蒸發皿中出現較多固體時,停止加熱。(2)鐵能被磁鐵吸引,采用磁鐵吸引的方法,可除去銅粉中混有的少量鐵粉;碳酸鈉與氫氧化鈣(或氫氧化鋇)溶液反應生成碳酸鈣(或碳酸鋇)沉澱和氫氧化鈉,因此可采用加入适量氫氧化鈣(或氫氧化鋇)溶液再過濾的方法,除去氫氧化鈉溶液中的碳酸鈉。

以上就是小編為大家準備的全部内容,謝謝閱覽
,更多精彩资讯请关注tft每日頭條,我们将持续为您更新最新资讯!




