
一、空氣中氧氣含量的測定
1.操作步驟:在集氣瓶内加入少量水,并将水面上方空間分為5等份。用止水夾加緊膠皮管。點燃燃燒匙内的紅磷後。立即伸入瓶中并把塞子塞緊,觀察紅磷燃燒的現象。待紅磷熄滅并冷卻後,打開止水夾,觀察實驗現象及水面的變化情況。
2.實驗現象:有大量白煙産生,集氣瓶内水面上升了約1/5體積。
3.實驗結論:氧氣體積約占空氣體積的1/5。
4.注意事項:①紅磷要取足量或過量;②實驗前檢查裝置氣密性;③止水夾夾緊;④點燃紅磷後立即伸入瓶中并把塞子塞緊;⑤要冷卻完全。
二、高錳酸鉀制氧
1.操作步驟:查-裝-定-點-收-離-熄
2.實驗現象:有大量氣體進入集氣瓶中
3.實驗結論:利用高錳酸鉀可以制氧
4.注意事項:
①試管口略向下傾斜:防止冷凝水倒流引起試管破裂
②藥品平鋪在試管的底部:均勻受熱
③鐵夾夾在離管口約1/3處
④導管應稍露出橡皮塞:便于氣體排出
⑤試管口應放一團棉花:防止高錳酸鉀粉末進入導管
⑥排水法收集時,待氣泡均勻連續冒出時再收集(剛開始排出的是試管中的空氣)
⑦實驗結束時,先移導管再熄滅酒精燈:防止水倒吸引起試管炸裂
⑧用向上排空氣法收集氣體時,導管伸到集氣瓶底部

三、電解水
1.操作步驟:在一個盛有水的水槽中倒立兩支盛滿水的試管,接通
直流電源,觀察電極上和試管内有什麼現象發生。切斷裝置的電源,在水下用拇指堵住試管口,把試管取出,直立後松開拇指,立即把帶有火星的木條伸入試管,進行觀察。
2.實驗現象:通電後,電極上出現了氣泡,通電一段時間以後,正、負兩極産生的氣體體積比大約為1:2。伸入正極試管裡的帶火星木條燃燒,負極試管裡的氣體/燃燒并出現淡藍色火焰。
3.實驗結論:水是由氫、氧兩種元素組成的。
4.注意事項:①水中可加入少量硫酸鈉或氫氧化鈉以增強導電性。②在實驗進程剛開始時,氧氣和氫氣的體積比與1:2不符,是因為氧氣不易溶于水,但會溶解一小部分;氫氣難溶,反應速率較慢,所以氫氣較少。

四、木炭還原氧化銅
1.操作步驟:把剛烘幹的木炭粉末和氧化銅粉末混勻,小心地鋪放進試管,并将試管固定在鐵架台上。試管口裝有通入澄清石灰水的導管,用酒精燈加熱混合物幾分鐘。然後先撤出導氣管,待試管冷卻後再把試管裡的粉末倒在紙上,觀察現象。
2.實驗現象:黑色粉末逐漸變為紅色,石灰水變渾濁。
3.實驗結論:碳具有還原性。
4.注意事項:①反應完後先将盛有石灰水的試管移走,防止液體倒吸進入試管,使熱的試管炸裂。②實驗完畢不能立即将試管内的物質倒出觀察,防止高溫的銅與空氣中的氧氣反應重新氧化成氧化銅。

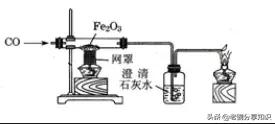
五、一氧化碳還原氧化銅
1.操作步驟:按如圖所示的裝置在玻璃管裡放入氧化銅,先通CO,後加熱,反應完畢先停止加熱,至玻璃管冷卻後停止通入CO。
2.實驗現象:黑色固體變成紅色,澄清石灰水變渾濁,末端導管處産生藍色火焰。
3.實驗結論:一氧化碳具有還原性。
4.注意事項:實驗前要對一氧化碳進行驗純。

六、鐵的冶煉
1.操作步驟:按如圖所示的裝置在玻璃管裡放入氧化鐵,先通CO,後加熱,反應完畢先停止加熱,至玻璃管冷卻後停止通入CO。
2.實驗現象:玻璃管裡的粉末由紅棕色逐漸變黑,澄清石灰水變渾濁。
3.實驗結論:煉鐵的原理就是利用一氧化碳與氧化鐵的反應。
4.注意事項:反應結束後應先停止加熱,待冷卻後停止通氣。
七、鐵制品鏽蝕條件
1.操作步驟:
(1)在第一支試管中放入一根鐵釘,注入蒸餾水,不要浸沒鐵釘,使鐵釘與空氣和水接觸。
(2)在第二支試管中放入一根鐵釘,注入剛煮沸過的蒸餾水(以趕走水中溶解的空氣)至浸沒鐵釘,然後在水面上加一層植物油,使鐵釘隻與水接觸。
(3)将第三支試管用酒精燈烘幹,放入一根鐵釘,用橡皮塞塞緊試管口,使鐵釘隻與幹燥的空氣接觸。
每天觀察鐵釘生鏽的情況,并認真做好記錄。
2.實驗現象:Ⅰ中鐵釘生鏽,Ⅱ中鐵釘不生鏽,Ⅲ中鐵釘不生鏽。
3.實驗結論:鐵生鏽的過程實際上是鐵與空氣中的氧氣和水蒸氣發生化學反應的過程。
4.注意事項:①要用蒸餾水;②要用潔淨無鏽的鐵釘。

聲明:本文來自“初中物理化學”,若涉及版權問題,請盡快聯系删除,謝謝!
,更多精彩资讯请关注tft每日頭條,我们将持续为您更新最新资讯!
