我是木有正事兒了嗎,點擊右上方關注,與你分享一些化學學習的技巧。
首先對高考選科選化學的同學說一聲,你們是值得鼓勵的勇士[強][強]再次對選擇選修三的同學說一聲,你們将打開一扇新世界的大門。因為選修三講的東西實在是太微觀了[流淚]。
前幾天在征求粉絲朋友的意見時,有個朋友留言說想看看關于物質結構和有機的知識點。我也不知道說的結構是不是選修三。那就先介紹選修三吧。
選修三總結成三個詞語就是“原子”、“分子”、“晶體”
這本書的考點彙總如下:
①原子:電子排布(式、圖)原理、周期表和周期律(位構性)
②分子:化學鍵(能長角)及文字解釋、氫鍵、空間構型、配位化合物、性質規律
③晶體:五大晶體類型及其性質、晶胞計算及其他陌生信息。
如果高考選修三出15分的題的話,将上面的3句話所包含的東西整明白了,能拿13分。[奮鬥][奮鬥]

微觀世界的大門正式敞開
我們先從原子結構及周期律開始說起:說起原子的結構,下面幾個基本知識點需要準确理解并會應用。這是基礎中的基礎。
軌道與亞層原子的電子排布式你得會寫,下圖展示的能層、能級符号你得知道是啥東西,

這些符号和形狀你得記住
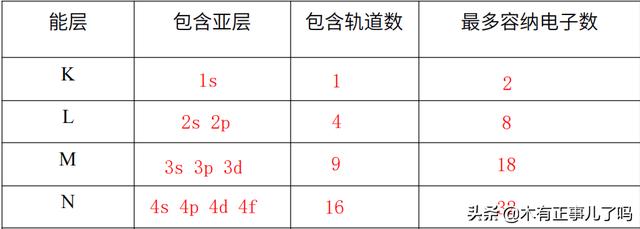
能層、亞層、軌道數、最多電子數等也要牢記
各能層包含亞層數、包含軌道數和最多容納電子數,也是常考的點,至于他們之間是怎麼算出來的:s亞層有1個軌道,p亞層有3個,依次類推(逐層 2)。能層包含的軌道數就是各亞層軌道數相加。1個軌道最多容納2個電子。所以,知道怎麼算,就沒必要死記硬背了。
三大電子填充規則能量最低原則:電子的排布總是優先占據能量最低的軌道;

就按照上圖所示的箭頭方向書寫排布式,記住
4s軌道要寫在3d之前(千萬要記住)
泡利不相容原則:同一軌道出現的兩個電子自旋方向必須相反;
洪特規則:每個亞層中電子優先以自旋方向相同的方式填充軌道。
電子排布類型中,比較穩定的狀态有半滿、全滿、全空。
考點:給你一個排布式,問你違背了哪個規則。這三個原則一定要記住,一定要記住。
電子排布式書寫的特殊形式1、說啥也得記住第四周期過渡元素的電子排布
[Ar]----原子實,代表簡化前18個電子
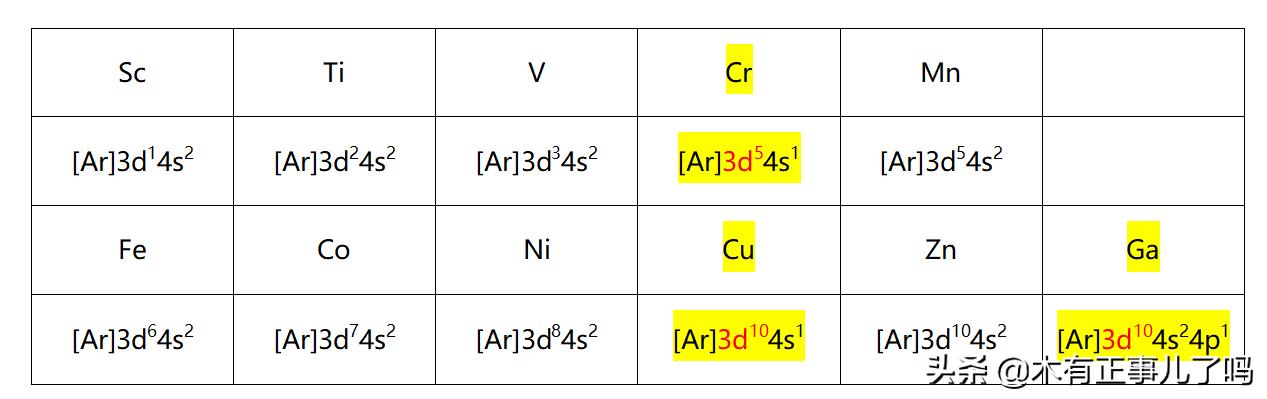
标黃和标紅的,表示半滿、全滿的狀态
關于3d和4s的排序問題:
得到電子時,電子先進入4s軌道,後進入3d軌道,原因是4s的能量會低于3d,存在能級交錯現象;
失去電子變成離子時:先失去4s上的電子,後失去3d上的軌道.舉個亞鐵離子的例子:
Fe2 :[Ar]3d6
這部分的考察形式通常如下:
如:①Cu原子M層電子排布式為:
②基态鐵原子有幾個未成對電子,基态3價鐵離子的電子占據的最高能層符号為:,該層具有的軌道數為:
③磷在成鍵時,能将一個3s電子激發進入3d能級而參與成鍵,寫出該激發态原子的和外電子排布式:
④各能級最多容納的電子書,是該能級原子軌道數的二倍,支撐這一結論的理論是什麼?
綜上,做這種題沒什麼訣竅,想拿到這些分數,元素周期表和周期律得學明白。想學明白,這篇文章都沒有你們的課本好用,死磕教科書就行。我們下篇文章見。
,更多精彩资讯请关注tft每日頭條,我们将持续为您更新最新资讯!




