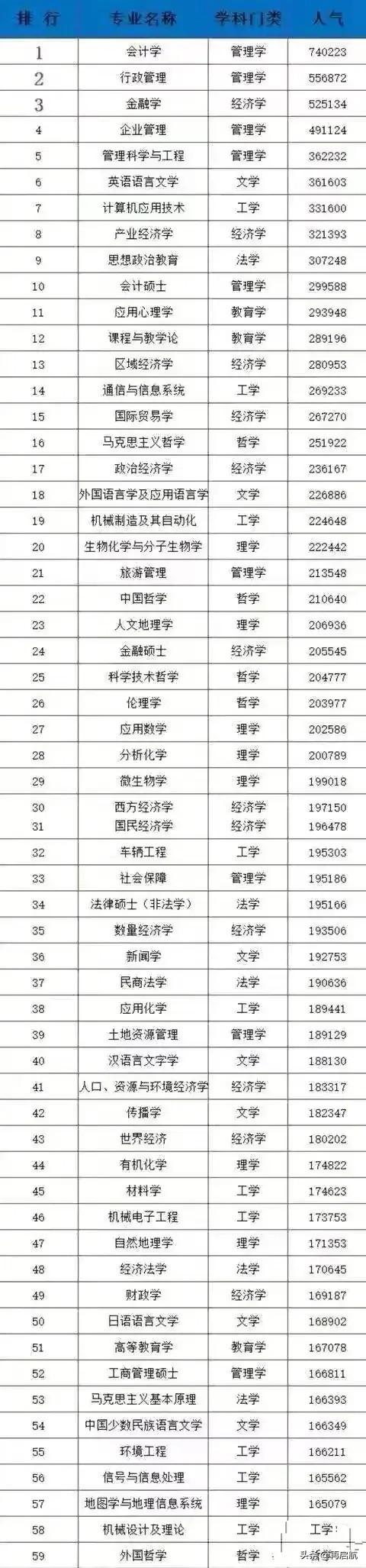
1.熟記15組物質,掌握常見變化規律
氧化劑
Cl2
O2
濃H2SO4
HNO3
KMnO4(H+)、
MnO2
Fe3+
KClO3、
ClO-
H2O2
對應還原産物
Cl-
O2-
SO2
NO或NO2
Mn2+
Fe2+
Cl-
H2O
還原劑
I-(HI)
S2(H2S)
CO、C
Fe2+
NH3
SO2、SO32-
H2O2
對應氧化産物
I2
S
CO2
Fe3+
NO
SO42-
O2
2.氧化性及還原性的強弱比較
(1)劑>産物:氧化劑氧化性強于氧化産物,還原劑還原性強于還原産物。
(2)根據活動性順序:在金屬活動性順序表中,位置越靠前,其單質還原性就越強,其陽離子的氧化性就越弱。同理,依據非金屬活動順序表,位置越靠前,其單質氧化性越強,其陰離子的還原性就越弱。
(3)根據元素周期表:同周期元素,随着核電荷數的遞增,單質氧化性逐漸增強,還原性逐漸減弱;同主族元素,随着核電荷數的遞增,單質氧化性逐漸減弱,還原性逐漸增強。
(4)根據反應的難易程度:不同的還原劑(或氧化劑)與同一氧化劑(或還原劑)反應時,條件越易或者氧化劑(或還原劑)被還原(或被氧化)的程度越大,則還原劑(或氧化劑)的還原性(或氧化性)就越強。
(5)根據電化學原理判斷:兩種不同的金屬構成原電池的兩極,負極金屬是電子流出的極,正極金屬是電子流入的極,負極還原性強于正極。用惰性電極電解混合液時,若混合液中存在多種金屬陽離子時,在陰極先放電的陽離子的氧化性較強(相應的金屬單質的還原性較弱),若混合液中存在多種陰離子,在陽極先放電的陰離子的還原性較強(相應的非金屬單質的氧化性較弱)。
(6)一般溶液的酸性越強或溫度越高,則氧化劑的氧化性和還原劑的還原性就越強,反之則越弱。
3.氧化還原反應概念判斷中的7個“不一定
(1)元素由化合态變為遊離态不一定被還原,也可以被氧化,如在反應2H2O2H2↑ O2↑中,氫元素被還原,而氧元素被氧化。
(2)得電子難的物質不一定易失電子,如第ⅣA族和稀有氣體。
(3)含有同種元素不同價态的物質,價态越高其氧化性不一定越強。如氧化性:HClO>HClO4。
(4)有單質參加的反應,不一定是氧化還原反應,如3O2===2O3。
(5)某一原子在反應中得到或失去的電子數越多,其氧化性或還原性不一定越強。物質的氧化性或還原性的強弱取決于得到或失去電子的難易程度,而不是得到或失去電子數目的多少
(6)依據金屬活動性順序判斷陽離子的氧化性強弱時,要注意Fe對應的陽離子是Fe2 ,而不是Fe3 。
(7)具有還原性物質與具有氧化性物質不一定都能發生氧化還原反應,如SO2與濃H2SO4、Fe3+與Fe2+不反應。
4.四大規律
(1)價态規律:元素處于最高價時,隻有氧化性;元素處于最低價時,隻有還原性;元素處于中間價态時,既有氧化性又有還原性,但主要呈現一種性質。物質若含有多種元素,其性質是這些元素性質的綜合體現。
(2)難易規律:越易失電子的物質,失電子後就越難得電子,越易得電子的物質,得電子後就越難失電子。一種氧化劑同時和幾種還原劑反應時,還原性最強的優先發生反應;同理,一種還原劑同時和多種氧化劑反應時,氧化性最強的優先發生反應。
(3)轉化規律:同種元素不同價态之間若發生反應,元素的化合價隻靠近而不交叉,同種元素相鄰價态間不發生氧化還原反應
例如:濃H2SO4與SO2不會發生反應,KClO3 6HC1(濃)=KCl 3C12↑ 3H2O反應中,KClO3中 5價氯元素不會轉化為KCl中-1價氯元素。
(4)守恒規律:氧化還原反應中氧化劑得電子、還原劑失電子,且得電子總數等于失電子總數。電子守恒法解題的思維流程:
A.找出反應中的氧化劑、還原劑及相應的還原産物和氧化産物。
B.找出一個原子或離子得失電子數目,從而确定1 mol氧化劑或還原劑得失電子數目(注意化學式中原子或離子個數,如1 mol K2Cr2O7被還原為+3價的Cr得電子數是3×2NA)。
C.根據題目中各物質的物質的量和得失電子守恒列出等式:
n(氧化劑)×變價原子數×化合價變化值=n(還原劑)×變價原子數×化合價變化值,從而求算出答案。
5..配平的方法
(1)若氧化劑、還原劑中某元素化合價全部變化,一般從左邊反應物着手配平。
(2)自身氧化還原反應(包括分解、歧化)一般從右邊着手配平。
(3)缺項配平法:先按得失電子數配平,再觀察兩邊電荷。若反應物缺正電荷,一般加H ,生成物一邊加水;若反應物缺負電荷,一般加OH-,生成物一邊加水,然後配平兩邊電荷數。
(4)當化學方程式中有多個缺項時,應根據化合價的變化找準氧化劑、還原劑、氧化産物、還原産物。
真題訓練

A.1:2 B.1:1 C.2:1 D.4:1


B.具有吸水性,需要密封保存


3.[2020年山東(新高考)]下列叙述不涉及氧化還原反應的是
A.谷物發酵釀造食醋 B.小蘇打用作食品膨松劑
C.含氯消毒劑用于環境消毒 D.大氣中NO2參與酸雨形成
4.[2019北京]下列除雜試劑選用正确且除雜過程不涉及氧化還原反應的是
物質(括号内為雜質)
除雜試劑
A
FeCl2溶液(FeCl3)
Fe粉
B
NaCl溶液(MgCl2)
NaOH溶液、稀HCl
C
Cl2(HCl)
H2O、濃H2SO4
D
NO(NO2)
H2O、無水CaCl2
5.[2019浙江4月選考]反應8NH3+3Cl2N2+6NH4Cl,被氧化的NH3與被還原的Cl2的物質的量之比為
A.2∶3 B.8∶3 C.6∶3 D.3∶2
6.[2018北京]下列實驗中的顔色變化,與氧化還原反應無關的是
A
B
C
D
實驗
NaOH溶液滴入FeSO4溶液中
石蕊溶液滴入氯水中
Na2S溶液滴入AgCl濁液中
熱銅絲插入稀硝酸中
現象
産生白色沉澱,随後變為紅褐色
溶液變紅,随後迅速褪色
沉澱由白色逐漸變為黑色
産生無色氣體,随後變為紅棕色
參考答案
1.B
【解析】由反應方程式可知,反應物MnO2中的Mn元素的化合價為 4價,生成物MnCl2中Mn元素的化合價為 2價,反應物HCl中Cl元素的化合價為-1價,生成物Cl2中Cl元素的化合價為0價,故MnCl2是還原産物,Cl2是氧化産物,由氧化還原反應中得失電子守恒可知,n(Cl2):n(MnCl2)=1:1,B符合題意;
答案選B。
2.D
【解析】将Ca3SiO5改寫為氧化物形式後的化學式為:3CaO·SiO2,性質也可與Na2SiO3相比較,據此解答。

B.CaO能與水反應,所以需要密封保存,B正确;
C.亞硫酸的酸性比矽酸強,當二氧化硫通入到Ca3SiO5溶液時,發生反應:3SO2 H2O Ca3SiO5=3 CaSO3 H2SiO3,C正确;
D.鹽酸的酸性比矽酸強,當鹽酸與Ca3SiO5反應時,發生反應:6HCl Ca3SiO5=3CaCl2 H2SiO3 2H2O,D不正确;故選D。
3.B
【解析】A.涉及澱粉水解成葡萄糖,葡萄糖氧化成乙醇,乙醇氧化成乙酸,涉及氧化還原反應,A不符合題意;
B.小蘇打即NaHCO3,NaHCO3受熱分解産生無毒的CO2,因此可用小蘇打作食品膨松劑,不涉及氧化還原反應,B符合題意;
C.利用含氯消毒劑的強氧化性消毒殺菌,涉及氧化還原反應,C不符合題意;
D.NO2與水反應有HNO3産生,因此NO2參與了硝酸型酸雨的形成,涉及氧化還原反應,D不符合題意。
答案選B。
4.B
【解析】發生的反應中,存在元素的化合價變化,與氧化還原反應有關;反之,不存在元素的化合價變化,則與氧化還原反應無關,以此解答該題。
A.FeCl3與Fe反應生成FeCl2,FeCl3 Fe=2FeCl2,此過程中Fe的化合價發生變化,涉及到了氧化還原法應,故A不符合題意;
B.MgCl2與NaOH溶液發生複分解反應MgCl2 2NaOH=Mg(OH)2 2NaCl,過量的NaOH溶液可用HCl除去HCl NaOH=NaCl H2O ,此過程中沒有元素化合價發生變化,未涉及氧化還原反應,故B符合題意;
C.部分氯氣與H2O 發生反應生成氯化氫和次氯酸,反應過程中氯元素化合價變化,涉及到了氧化還原法應,故C不符合題意;
D.NO2 與水反應生成硝酸和NO。反應過程中氮元素化合價發生變化,涉及到了氧化還原法應,故D不符合題意;
綜上所述,本題應選B。
5.A
【解析】該氧化還原反應用雙線橋表示為,可知實際升價的N原子為2個,所以2個NH3被氧化,同時Cl2全部被還原,觀察計量數,Cl2為3個,因而被氧化的NH3與被還原的Cl2的物質的量之比為2:3。
故答案選A。
6.C

更多精彩资讯请关注tft每日頭條,我们将持续为您更新最新资讯!