原創: 貓妖嬌嬌 化學好教師
水的電離
(1)電離平衡和電離程度
水是極弱的電解質,能微弱電離
H2O H2O H3O OH-,通常簡寫為H2O H OH-;ΔH>0
25℃ 時,純水中 c(H )=c(OH - )=1×10 -7 mol/L

(2)水的離子積
在一定溫度時,c(H )與c(OH-)的乘積是一個常數,稱為水的離子積常數,簡稱水的離子積。
KW=c(H )·c(OH-),25℃時,KW=1×10-14(無單位)。
①KW隻受溫度影響,水的電離吸熱過程,溫度升高,水的電離程度增大,KW增大。
25℃時KW=1×10-14,100℃時KW約為1×10-12。
②水的離子積不僅适用于純水,也适用于其他稀溶液。不論是純水還是稀酸、堿、鹽溶液,隻要溫 度不變,KW就不變。

(3)影響水的電離平衡的因素
①溫度
溫度越高電離程度越大
c(H )和c(OH-)同時增大,KW增大,但c(H )和c(OH-)始終保持相等,仍顯中性。
純水由25℃升到100℃,c(H )和c(OH-)從1×10-7mol/L增大到1×10-6mol/L(pH變為6)。

②酸、堿
向純水中加酸、堿平衡向左移動,水的電離程度變小,但KW不變。
③加入易水解的鹽
由于鹽的離子結合H 或OH-而促進水的電離,使水的電離程度增大。溫度不變時,KW不變。
練習:影響水的電離平衡的因素可歸納如下:


溶液的酸堿性
溶液的酸堿性取決于溶液中的c(H )與c(OH-)的相對大小。
在常溫下,中性溶液:c(H )=c(OH-)=1×10-7mol/L;
酸性溶液:c(H )>c(OH-), c(H )>1×10-7mol/L;
堿性溶液:c(H )<c(OH-),c(H )<1×10-7‑mol/L。
思考:c(H )>1×10-7mol/L(pH<7)的溶液是否一定成酸性?

溶液的pH
⑴表示方法
pH=-lgc(H ) c(H )=10-pH
pOH=-lgc(OH-) c(OH-)=10-pOH
常溫下,pH pOH=-lgc(H )-lgc(OH-)=-lgc(H )·c(OH-)=14。
⑵溶液的酸堿性與pH的關系(常溫時)
①中性溶液:c(H )=c(OH-)=1×10‑7mol·L-1,pH=7。
②酸性溶液:c(H )>1×10-7mol·L-1>c(OH-),pH<7,酸性越強,pH越小。
③堿性溶液:c(H )<1×10-7mol·L-1>c(OH-),pH>7,堿性越強,pH越大。
思考:1、甲溶液的pH是乙溶液的2倍,則兩者的c(H )是什麼關系?
2、pH<7的溶液是否一定成酸性?(注意:pH=0的溶液c(H )=1mol/L。)
⑶pH的适用範圍
c(H )的大小範圍為:1.0×10-14mol·L-1<c(H )<1mol·L-1。即pH 範圍通常是0~14。
當c(H )≥1mol·L-1或c(OH-)≥1mol·L-1時,用物質的量濃度直接表示更方便。
⑷溶液pH的測定方法
①酸堿指示劑法:
隻能測出pH的範圍,一般不能準确測定pH。
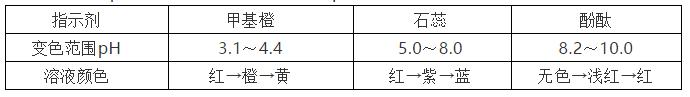
②pH試紙法:
粗略測定溶液的pH。
pH試紙的使用方法:取一小塊pH試紙放在玻璃片(或表面皿)上,用潔淨的玻璃棒蘸取待測液滴在試紙的中部,随即(30s内)與标準比色卡比色對照,确定溶液的pH。
測定溶液pH時,pH試劑不能用蒸餾水潤濕(否則相當于将溶液稀釋,使非中性溶液的pH測定産生誤差);不能将pH試紙伸入待測試液中,以免污染試劑。
标準比色卡的顔色按pH從小到大依次是:紅 (酸性),藍 (堿性)。
③pH計法:精确測定溶液pH。
4、有關pH的計算
基本原則:
一看常溫,二看強弱(無強無弱,無法判斷),三看濃度(pH or c)
酸性先算c(H ),堿性先算c(OH—)
⑴單一溶液的pH計算
①由強酸強堿濃度求pH
②已知pH求強酸強堿濃度
⑵加水稀釋計算
①強酸pH=a,加水稀釋10n倍,則pH=a n。
②弱酸pH=a,加水稀釋10n倍,則pH<a n。
③強堿pH=b,加水稀釋10n倍,則pH=b-n。
④弱堿pH=b,加水稀釋10n倍,則pH>b-n。
⑤酸、堿溶液無限稀釋時,pH隻能約等于或接近于7,酸的pH不能大于7,堿的pH不能小于7。
⑥對于濃度(或pH)相同的強酸和弱酸,稀釋相同倍數,強酸的pH變化幅度大。
⑶酸堿混合計算
①兩種強酸混合
c(H )混=
②兩種強堿混合
c(OH-)混=
③酸堿混合,一者過量時
c(OH-)混或c(H )混=
若酸過量,則求出 c(H ) ,再得出 pH ;若堿适量,則先求c(OH-),再由KW得出c(H ),進而求得pH,或由c(OH-)得出pOH再得pH。
溶液酸堿性pH計算經驗規律
(1)兩強酸等體積混合 混合後的pH=小的 0.3
(2)兩強堿等體積混合 混合後的pH=大的—0.3
(3)當按所給反應物質的量之比計算時,酸堿不論強弱,誰大誰過剩,溶液呈誰性。
(5)pH 減小一個單位,[H ]擴大為原來的10倍。PH增大2個單位,[H ]減為原來的1/100
(6)稀釋規律:分别加水稀釋m倍時,溶液的物質的量的濃度均變為原來的 1/m , 強酸中c(H )變為原來的1/m ,但弱酸中c(H )減小小于m倍,故稀釋後弱酸酸性強于強酸。

酸堿中和滴定
主要儀器
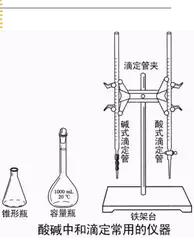
(1)滴定管
滴定管分為________滴定管和________滴定管。酸性溶液裝在________滴定管中,堿性溶液裝在________滴定管中。如圖所示:
(2)錐形瓶、燒杯、鐵架台、滴定管夾等。
2.主要試劑
标準液、待測液、_指示劑_、蒸餾水。
3.實驗操作(用标準鹽酸滴定待測NaOH溶液)
1.準備:①洗滌 ②查漏 ③潤洗 ④裝液體 ⑤排氣泡 ⑥調整液面 ⑦讀數
2.滴定:①量取待測液并加指示劑 ②滴定至終點并讀數
③重複操作三次 ④計算

【注意】

①滴定時在瓶底墊一張白紙;
②滴定時左手控制旋鈕、右手振蕩錐形瓶、目光注視錐形瓶内溶液顔色變化。
③錐形瓶:隻用蒸餾水洗滌,不能用待測液潤洗
④先快後慢,當接近終點時,應一滴一搖
⑤注入标準液至“0”刻度上方2~3cm處,将液面調節到“0”刻度(或“0”刻度以下某一刻度)
注意:指示劑的選擇:變色靈敏、明顯。一般用酚酞,不用石蕊
4.常用酸堿指示劑及變色範圍

5.滴定終點判斷
當最後一滴剛好使指示劑顔色發生明顯的改變而且半分鐘内不恢複原來的顔色,即為滴定終點。

問題思考

(1)KMnO4(H+)溶液、溴水、Na2CO3溶液、稀鹽酸應分别盛放在哪種滴定管中?
(2)滴定終點就是酸堿恰好中和的點嗎?
6.酸堿中和滴定的誤差分析

原理

(以标準鹽酸滴定待測NaOH溶液為例)
cB=
VB——準确量取的待測液的體積;
cA——标準溶液的濃度。
c(待)的大小取決于V(标)的大小,V(标)大,則c(待)大,V(标)小,則c(待)小。

常見誤差

以标準酸溶液滴定未知濃度的堿(酚酞作指示劑)為例,常見的因操作不正确而引起的誤差有:

更多精彩资讯请关注tft每日頭條,我们将持续为您更新最新资讯!




